O eixo intestino-cérebro é a conexão entre o sistema digestivo e o sistema nervoso central. Essa interação é mediada por hormônios, neurotransmissores e o sistema imunológico. Estudos mostram que a saúde intestinal pode impactar diretamente o comportamento, o humor e as funções cognitivas.
A prevalência de distúrbios cerebrais, incluindo distúrbios neuropsiquiátricos relacionados ao estresse e condições com disfunção cognitiva, está aumentando. Os maus hábitos alimentares contribuem substancialmente para essa tendência acelerada. Por outro lado, a ingestão alimentar saudável apoia o humor e o desempenho cognitivo. Recentemente, a comunicação entre os microrganismos dentro do trato gastrointestinal e o cérebro ao longo do eixo intestino-cérebro ganhou destaque como um potencial alvo tratável para modular a saúde do cérebro. A composição e a função da microbiota intestinal são fortemente influenciadas por fatores dietéticos para alterar a sinalização intestino-cérebro. Para refletir essa interconexão entre dieta, microbiota intestinal e funcionamento do cérebro, propomos que existe um eixo dieta-microbiota-intestino-cérebro que sustenta a saúde e o bem-estar. Nesta revisão, fornecemos uma visão abrangente da interação entre dieta e composição e função da microbiota intestinal e as implicações para a cognição e o funcionamento emocional. Importantes efeitos induzidos pela dieta na microbiota intestinal para o desenvolvimento, prevenção e manutenção de distúrbios neuropsiquiátricos são descritos. O eixo dieta-microbiota-intestino-cérebro representa uma fronteira desconhecida para diagnósticos e terapias da saúde cerebral ao longo da vida.
Pesquisas nas últimas duas décadas estabeleceram uma capacidade notável da microbiota intestinal de modular a atividade e o comportamento cerebral. Por outro lado, os sinais do cérebro podem influenciar a composição e a função da microbiota intestinal. Essa comunicação bidirecional através do eixo microbiota intestinal-cérebro, envolvendo vários mediadores bioquímicos e celulares, é reconhecida como uma importante rede cérebro-corpo que integra pistas do ambiente e do estado interno do corpo. Central para essa rede é o sistema sensorial intestinal, formado por conexões íntimas entre células epiteliais quimiossensoriais e fibras nervosas sensoriais, que transmitem sinais interoceptivos ao sistema nervoso central.
A comunicação bidirecional entre a microbiota intestinal e o cérebro, o eixo microbiota-intestino-cérebro, ocorre por meio de várias vias, incluindo o nervo vago, o sistema imunológico, vias neuroendócrinas e metabólitos derivados de bactérias. Este eixo demonstrou influenciar a neurotransmissão e o comportamento frequentemente associados a condições neuropsiquiátricas. Portanto, pesquisas que visam a modulação dessa microbiota intestinal como uma nova terapia para o tratamento de várias condições neuropsiquiátricas estão ganhando interesse. Numerosos fatores foram destacados para influenciar a composição da microbiota intestinal, incluindo genética, estado de saúde, modo de nascimento e meio ambiente. No entanto, é a composição da dieta e o estado nutricional que têm se mostrado repetidamente um dos fatores modificáveis mais críticos que regulam a microbiota intestinal em diferentes momentos ao longo da vida e sob várias condições de saúde. Assim, a microbiota está pronta para desempenhar um papel fundamental nas intervenções nutricionais para manter a saúde do cérebro.
A importância dos microrganismos em todos os aspectos da saúde e doença humana é cada vez mais reconhecida, incluindo a saúde do cérebro. De fato, o eixo microbioma-intestino-cérebro emergiu como uma nova fronteira com implicações para nossa compreensão da fisiologia humana.
Uma ênfase crescente está sendo colocada agora em desembaraçar os mecanismos de comunicação ao longo desse eixo.Coexistimos com trilhões de microrganismos, incluindo bactérias, vírus, fungos e outros micróbios que residem em vários nichos do corpo e que são reconhecidos como um determinante chave da saúde e da doença.
O microbioma intestinal refere-se especificamente aos genomas coletivos de todos os microrganismos que vivem no intestino.
Os avanços na tecnologia de sequenciamento e bioinformática aprofundaram nossa compreensão das comunidades microbianas, destacando seu papel crítico na programação de sistemas corporais e influenciando a saúde do hospedeiro. A microbiota intestinal, e o bacterioma em particular, ganhou atenção por seu impacto na maturação imunológica, neuroinflamação e perfis neurocomportamentais além das métricas de diversidade.
A imunidade inata atua como a primeira linha de defesa do hospedeiro, integrando sinais da microbiota intestinal para orquestrar respostas imunes localizadas e sistêmicas. A imunidade adaptativa, com sua especificidade e memória características, refina ainda mais essas respostas para manter um equilíbrio delicado entre tolerância e defesa. Juntos, esses dois braços do sistema imunológico são pilares importantes da comunicação do eixo intestino-cérebro e medeiam muitos dos efeitos da microbiota intestinal no sistema nervoso central (SNC), influenciando uma série de processos neurológicos e psicológicos.
Esta matéria descreve as principais vias pelas quais a microbiota se comunica com o cérebro, enfatizando os papéis da imunidade inata e adaptativa nessa complexa interação recíproca, particularmente no contexto de interrupções relevantes do sistema imunológico em distúrbios do eixo intestino-cérebro. Ao explorar as propriedades imunomoduladoras da microbiota intestinal e seu impacto no SNC, destacaremos o potencial terapêutico de direcionar o eixo microbioma-intestino-cérebro, incluindo distúrbios neuromentais, neuropsiquiátricos relacionados ao estresse e neurológicos.
Interação do sistema imunológico e do eixo intestino-cérebro
A microbiota intestinal e o cérebro se comunicam por meio de várias vias, abrangendo conexões neuronais e mensagens químicas, mas os detalhes exatos dos mecanismos que facilitam essas interações ainda precisam ser totalmente elucidados (ver Figura 1). Nas seções a seguir, nos concentramos nos principais mecanismos imunomoduladores de comunicação entre o intestino e o cérebro, antes de nos concentrarmos em aspectos específicos dos sistemas imunológicos inato e adaptativo que estão envolvidos na comunicação do eixo microbioma-intestino-imunocérebro.
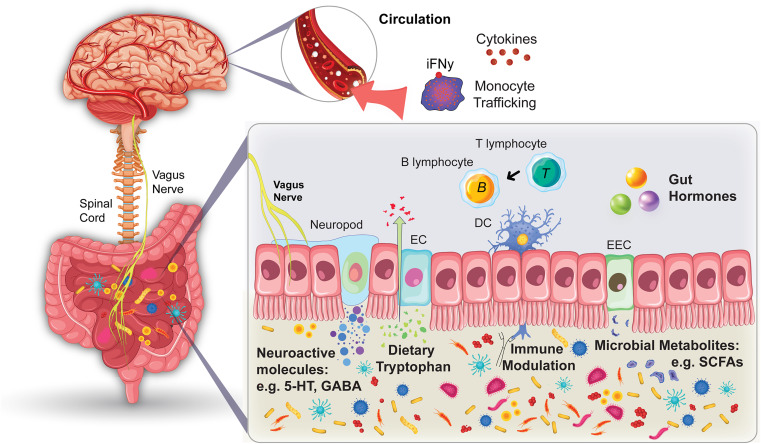
Figura 1 Mecanismos de comunicação do eixo microbiota intestinal-imunocérebro-cérebro
Vias endócrinas
A endocrinologia microbiana destaca uma linguagem neuroquímica compartilhada entre o hospedeiro e os micróbios, com bactérias produzindo e respondendo a neuroquímicos como serotonina (5-hidroxitriptamina [5-HT]), ácido γ-aminobutírico, catecolaminas e derivados indólicos, afetando o humor, a cognição e as respostas imunes do hospedeiro. O metabolismo do triptofano, compartilhado por mamíferos e bactérias, gera 5-HT e quinurenina, influenciando os sistemas serotoninérgicos gastrointestinais, a regulação imunológica e a saúde mental.
Metabólitos bacterianos derivados de triptofano, como indóis, afetam a integridade da barreira intestinal, inflamação e saúde metabólica, enquanto sua produção é diurna e responsiva ao estresse. A histamina derivada de bactérias induz hiperalgesia visceral, enquanto as β-glucuronidases, enzimas produzidas pelo hospedeiro e micróbios, afetam a desintoxicação, a inflamação e a doença.
As células enteroendócrinas desempenham um papel fundamental na comunicação intestino-cérebro, detectando metabólitos microbianos e liberando hormônios como o peptídeo-1 semelhante ao glucagon (GLP-1) e o peptídeo YY (PYY), influenciando a saciedade, as respostas imunes e a ingestão de alimentos. Notavelmente, as células L formam conexões sinápticas diretas com o ENS por meio de neurópodes, permitindo uma rápida sinalização intestino-cérebro. Os clostrídios formadores de esporos aumentam a biossíntese de 5-HT colônica, influenciando indiretamente a função cerebral por meio da atividade vagal e das respostas imunes.
Além disso, o intestino neonatal é rico em 5-HT produzido por bactérias específicas, que também regulam negativamente a monoamina oxidase A para aumentar a disponibilidade de 5-HT. Em neonatos, o 5-HT derivado de bactérias intestinais suporta a tolerância imunológica, promovendo a diferenciação de células T reguladoras, enfatizando seu papel crítico no desenvolvimento imunológico inicial.
Sinalização de metabólitos microbianos entre o intestino e o cérebro
Metabólitos microbianos, como ácidos graxos de cadeia curta (SCFAs) e ácidos biliares secundários, aumentam a secreção de peptídeos intestinais, GLP-1 e PYY, particularmente no intestino distal.
Ácidos biliares secundários, como ácido desoxicólico e poliaminas de ácido litocólico, podem comprometer a barreira epitelial, permitindo que componentes bacterianos como lipopolissacarídeo, peptidoglicano e flagelina se transloquem para a corrente sanguínea ou outros tecidos, desencadeando respostas imunes e inflamação sistêmica. As bacteriocinas, pequenos peptídeos ou proteínas antimicrobianas sintetizadas ribossômicas, também são produzidas por bactérias que podem ter um espectro estreito ou amplo de atividade contra outras bactérias, muitas vezes visando espécies intimamente relacionadas ou cepas específicas.
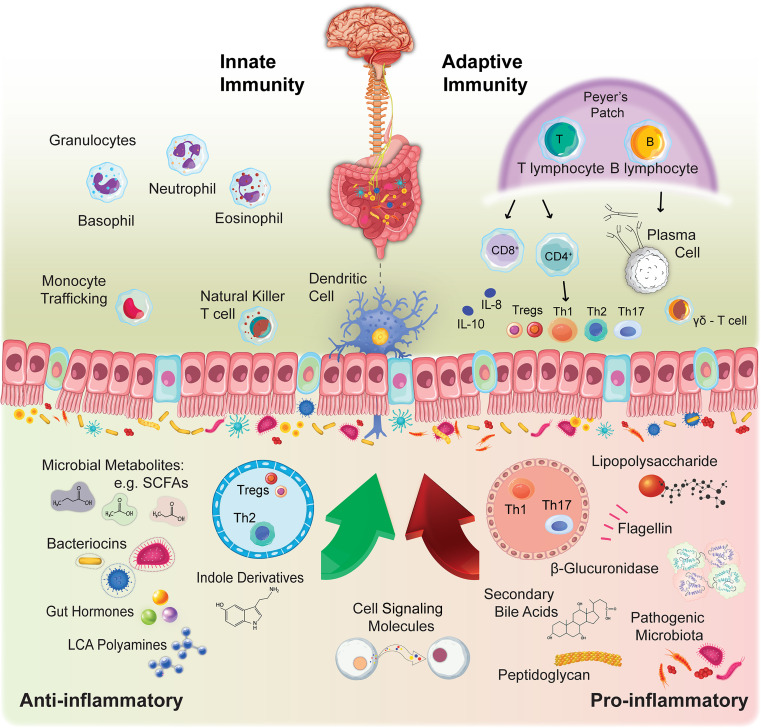
Figura 2 Imunidade inata vs. adaptativa e o microbioma intestinal
A quebra da barreira intestinal também aumenta a permeabilidade intestinal, muitas vezes chamada de “intestino permeável”, e tem ligações com condições que variam de doença inflamatória intestinal a distúrbios metabólicos. No entanto, este termo simplifica demais a complexa regulação da permeabilidade da barreira. Os SCFAs, produzidos pela microbiota intestinal a partir de fibras indigestas, influenciam a função imunológica, a pressão arterial e a fisiologia cerebral. O acetato, o propionato e o butirato podem modular a sinalização enteroendócrina, as vias intestino-cérebro e a imunidade do hospedeiro.
De fato, os SCFAs interagem com receptores acoplados à proteína G da membrana celular, como o receptor de ácido graxo livre 2 (FFAR2 ou GPR43), FFAR3 (ou GPR41) e o receptor de ácido hidroxicarboxílico 2; O FFAR2 é altamente expresso em células T reguladoras (Tregs) na mucosa intestinal, regulando a regulação do equilíbrio imunológico intestinal.
O eixo hipotálamo-hipófise-adrenal
O eixo hipotálamo-hipófise-adrenal (HPA) é central para a coordenação da resposta ao estresse e uma rota de comunicação chave dentro do eixo microbioma-intestino-cérebro.
As interações imuno-HPA, demonstradas por meio de translocação microbiana e ativação de citocinas inflamatórias, ressaltam o papel da microbiota intestinal na sinalização de HPA. O estresse ativa o hipotálamo para liberar o fator liberador de corticotrofina, levando a hipófise anterior a secretar hormônio adrenocorticotrófico, estimulando a liberação de glicocorticóides do córtex adrenal. Esses glicocorticóides preparam o corpo para respostas de “luta ou fuga”, preparam a resposta do sistema imunológico e fornecem feedback negativo ao hipotálamo e à hipófise. O estresse não afeta apenas a composição e atividade da microbiota intestinal, mas também promove a translocação microbiana, aumentando a ativação de citocinas inflamatórias (por exemplo, fator de necrose tumoral alfa [TNF-α]) e aumentando a permeabilidade intestinal, exacerbando os sintomas relacionados ao estresse. A inflamação mediada por citocinas permite que os produtos microbianos influenciem as funções sistêmicas e neurológicas, impactando a atividade do eixo HPA, como visto em camundongos livres de germes que apresentam respostas aumentadas ao estresse.
Intervenções como os probióticos podem modular os níveis de citocinas, mitigando os efeitos adversos do estresse no eixo HPA e restaurando a homeostase intestinal. Essas interações destacam o papel significativo das citocinas inflamatórias na comunicação intestino-cérebro, apresentando-as como potenciais alvos terapêuticos para o tratamento de distúrbios relacionados ao estresse. O diálogo entre o eixo HPA e outras vias de comunicação microbiota-cérebro, incluindo estimulação do nervo vago e interações imunológicas, destaca interações complexas que influenciam o estresse e as respostas inflamatórias. Mais recentemente, uma ênfase crescente tem sido colocada no papel da microbiota na integração das respostas do eixo HPA ao longo do ciclo circadiano.
Eixo microbiota intestinal-imuno-cérebro: foco no sistema imunológico inato e adaptativo
O sistema imunológico foi originalmente percebido como defensor contra micróbios patogênicos; agora é reconhecido que nosso sistema imunológico interage extensivamente com a microbiota intestinal, o que contribui para a saúde do hospedeiro.
Os comensais (microrganismos que vivem dentro ou sobre o corpo de um hospedeiro sem causar danos) desempenham papéis essenciais, incluindo o fornecimento de nutrientes, metabolização de compostos indigestos e prevenção da colonização de patógenos oportunistas. A interação entre o sistema imunológico do hospedeiro e os micróbios intestinais envolve mecanismos de reconhecimento, interpretação e resposta. O reconhecimento do hospedeiro ocorre por meio de várias vias descritas anteriormente (ou seja, SCFAs, metabólitos do triptofano e ácidos biliares). Há também um interesse crescente em como as células do sistema imunológico podem afetar o comportamento e a cognição, enquanto a função imunológica também afeta os principais processos cerebrais, como resposta a infecções, lesões ou autoimunidade. As células imunológicas podem se infiltrar no cérebro, desencadeando respostas inflamatórias. A neuroinflamação pode levar a alterações na função e estrutura cerebral, influenciando subsequentemente a cognição, o humor e o comportamento.
Citocinas e quimiocinas podem atravessar a barreira hematoencefálica (BHE), onde influenciam a atividade neuronal, a transmissão sináptica e a neurogênese. Além disso, a pele e as superfícies mucosas abrigam uma infinidade de microrganismos. Com o tempo, a resposta imune às bactérias comensais moldou a imunidade inata e adaptativa (incluindo linfócitos B e T nas placas de Peyer, plasmócitos e citocinas diferenciadas), formando ligações íntimas entre os três sistemas. No entanto, os mecanismos subjacentes a essas conexões ainda não são totalmente compreendidos.
O microbioma intestinal, estresse e sistema imunológico: implicações para distúrbios cerebrais
Há um foco crescente nos processos celulares que facilitam a migração de células imunes para o cérebro, particularmente no papel da microbiota intestinal nessas dinâmicas. Embora o SNC tenha sido historicamente considerado isolado do sistema imunológico periférico, agora se entende que as citocinas circulantes influenciam a função e o comportamento do cérebro.
Leucócitos periféricos, incluindo monócitos, células T e B e células T natural killer, podem acessar o líquido cefalorraquidiano, meninges, plexo coróide e cérebro. Dentro do SNC, o plexo coroide, macrófagos meníngeos e perivasculares, mastócitos e microglia (os macrófagos do cérebro) detectam patógenos ou danos teciduais e iniciam respostas imunes. O recrutamento de linfócitos acionado por quimiocinas para espaços perivasculares apoia ainda mais a imunidade do SNC. Desequilíbrios nos níveis de citocinas e aumento da migração de monócitos podem contribuir para condições neuroinflamatórias, potencialmente influenciadas pela microbiota intestinal.
Tais mudanças no estado imunológico, possivelmente influenciadas pela microbiota intestinal, podem ter efeitos profundos nas respostas neuroinflamatórias, potencialmente exacerbando as condições neuropsiquiátricas e neurológicas.A microglia exemplifica como a microbiota intestinal afeta o cérebro por meio de mecanismos imunológicos inatos. De fato, camundongos livres de germes exibem defeitos microgliais, incluindo números, maturação, morfologia e função metabólica alterados, ligados a respostas prejudicadas à infecção. Esses processos parecem ser regulados por SCFAs derivados de micróbios, especificamente acetato. O acetato derivado de bactérias modula os principais processos metabólicos da microglia no estado estacionário e pode resgatar a maturação microglial prejudicada em camundongos livres de germes.
A N6-carboximetillisina, um metabólito microbiano, também induz disfunção mitocondrial no envelhecimento da microglia. Os neutrófilos influenciam a microbiota intestinal e vice-versa, com metabólitos modulando a produção e a função dos neutrófilos. Além disso, a inflamação intestinal causada por neutrófilos tem sido associada ao transtorno do espectro do autismo (TEA), Doença de Parkinson (DP), e doença de Alzheimer (DA).
Na DA, os neutrófilos se acumulam perto de depósitos de β-amilóide (Aβ), e sua depleção nos estágios iniciais da doença melhora a memória em modelos de camundongos. Um estudo recente sugeriu que a inflamação intestinal aguda acelera o acúmulo de Aβ por meio do extravasamento de neutrófilos, que pode ser mitigado pela depleção de neutrófilos. Essas descobertas destacam um papel terapêutico potencial para direcionar neutrófilos através do eixo intestino-cérebro, embora sejam necessárias mais pesquisas.
Exposição ao estresse
O microbioma intestinal também é afetado pelo estresse. A pesquisa tem replicado consistentemente essas descobertas em diferentes cepas bacterianas, organismos e paradigmas de estresse. Além disso, sabe-se que o estresse altera a composição do microbioma intestinal e a fisiologia e função gastrointestinal. Um estudo recente mostrou que o transplante da microbiota intestinal de um modelo de camundongo induzido por estresse leve imprevisível crônico (CUMS) em camundongos livres de patógenos específicos (SPF) pode induzir um comportamento depressivo. A transferência do microbioma intestinal foi capaz de induzir a ativação do complemento C3 e a poda sináptica mediada pela micróglia em camundongos SPF, uma manifestação associada ao comportamento depressivo nos camundongos CUMS.
A ativação de células dendríticas (DC) também foi implicada em modelos pré-clínicos de exposição ao estresse e ansiedade resultante. Camundongos machos tratados com Lactobacillus rhamnosus (JB-1) diminuíram o comportamento de ansiedade induzido pelo estresse em comparação com animais tratados com veículo. Esta cepa JB-1 também demonstrou atenuar a ativação relacionada ao estresse de DCs enquanto aumenta os linfócitos T reguladores da interleucina (IL)-10. Tais estudos sugerem que a microbiota pode influenciar certos resultados neurológicos e comportamentais por meio da comunicação com DCs.Bactérias produtoras de butirato SCFA, como Faecalibacterium prausnitzii, demonstraram exercer efeitos anti-inflamatórios na colite e reduzir comportamentos semelhantes à ansiedade e depressão no teste de campo aberto, influenciando a relação Th17 / Treg de linfócitos ativados.
Notavelmente, a IL-17A emergiu como uma molécula-chave na interface entre o sistema imunológico adaptativo e o microbioma intestinal. Mais evidências dessa relação foram descobertas onde foi identificado um mecanismo de reparo neuronal coordenado por células T comensais específicas que secretam IL-17A. Essa citocina sinaliza posteriormente para os neurônios sensoriais por meio do receptor A de IL-17A, aumentando a recuperação neuronal. Assim, na superfície da mucosa, as células do sistema imunológico adaptativo e do microbioma podem se coordenar para influenciar o reparo do SNC.
Condições neuropsiquiátricas
Transtorno depressivo maior
Os transtornos de humor, como o transtorno depressivo maior (TDM), são condições complexas e debilitantes influenciadas pela inflamação e pelo microbioma intestinal.
Interrupções no eixo HPA, ativação imunológica alterada e distúrbios da microbiota intestinal demonstraram contribuir para a patologia do TDM. A inflamação crônica de baixo grau é reconhecida como um elemento-chave no desenvolvimento da depressão, e níveis elevados de células imunes circulantes (por exemplo, monócitos e granulócitos) foram observados em indivíduos com TDM; A supressão dessas citocinas reduz o comportamento depressivo em modelos animais. Além disso, os mastócitos, principais reguladores imunológicos inatos, têm sido implicados na depressão por meio de mecanismos ligados ao metabolismo do triptofano e à neuroinflamação.
Além disso, as células T contribuem para a patologia do TDM, com metanálises revelando disfunção imunológica, incluindo contagens alteradas de células T CD4 auxiliares e ativadas. Evidências crescentes ligam marcadores inflamatórios, como a proteína C-reativa (PCR), à depressão, ansiedade e déficits cognitivos.
A randomização mendeliana sugeriu relações causais entre PCR e ansiedade, apoiando os perfis de células imunes como potenciais biomarcadores de MDD para estratificação de pacientes. Coletivamente, esses estudos destacam o uso potencial de perfis de células imunes como biomarcadores para identificar subtipos de TDM e orientar a estratificação do paciente em ensaios futuros.Da mesma forma, esses estudos populacionais em larga escala também descobriram que as cepas bacterianas de Coprococcus e Dialister não apenas indicam melhor qualidade de vida, mas também são reduzidas em indivíduos com depressão não tratada, enquanto Butyricicoccus se relaciona com respostas ao tratamento antidepressivo.
Transplantes de matéria fecal (FMTs) de indivíduos com TDM induziram comportamentos depressivos em animais receptores, implicando o microbioma intestinal na fisiopatologia da depressão. Intervenções probióticas (por exemplo, cepas de L. helveticus, Bifidobacterium longum, Clostridium butyricum e L. plantarum) demonstraram efeitos benéficos nos escores de depressão, função cognitiva e capacidade de resposta ao tratamento.
O papel do microbioma intestinal na imunidade adaptativa, influenciando a função dos linfócitos T e B, sugere que as terapias direcionadas à microbiota podem abordar o TDM. Compreender a interação entre o microbioma, o sistema imunológico e a depressão pode informar novos tratamentos para distúrbios relacionados ao estresse.
Transtorno de ansiedade social
O transtorno de ansiedade social (TAS) (também conhecido como fobia social) é uma condição de saúde mental marcada por um medo profundo e contínuo de ser examinado, julgado ou humilhado em ambientes sociais. Esse medo avassalador leva os indivíduos a evitar situações sociais ou enfrentá-las com sofrimento significativo. Estudos recentes indicam uma ligação significativa entre a microbiota intestinal, a função imunológica e a ansiedade no contexto do TAS.
O FMT de indivíduos com TAS em camundongos revelou que a microbiota intestinal pode induzir maior sensibilidade ao medo social, refletindo os sintomas do TAS.
Essa resposta foi acompanhada por mudanças notáveis nas funções imunológicas centrais e periféricas e uma redução na expressão de ocitocina no núcleo do leito da estria terminal. As respostas imunes alteradas incluem diminuição da produção de IL-17A e perfis de células T alterados em tecidos linfóides associados ao intestino, indicando sinalização imunológica interrompida que se correlaciona com o fenótipo comportamental de aumento do medo social. O microbioma intestinal do TAS difere em composição e função daquele dos controles saudáveis, com níveis elevados de Anaeromassillibacillus e Gordonibacter em pacientes com TAS e Parasutterella nos controles.
Há necessidade de estudos longitudinais maiores para confirmar esses achados e explorar sua relevância clínica.
Distúrbios do neurodesenvolvimento
Esquizofrenia
Embora seja uma condição neuropsiquiátrica, a esquizofrenia também é considerada um distúrbio do neurodesenvolvimento resultante da interação entre suscetibilidade genética e estressores ambientais pré-natais e pós-natais. A esquizofrenia se manifesta com sintomas positivos e negativos, juntamente com déficits cognitivos. A interação entre genes e o ambiente posiciona o microbioma e o sistema imunológico na vanguarda das abordagens multissistêmicas para tratar a esquizofrenia. Vários fatores de risco para esquizofrenia destacam o trato gastrointestinal como uma área crítica de investigação. Estes incluem inflamação, sensibilidade ao glúten e exposição ao Toxoplasma gondii.
Fortes evidências apoiam o papel combinado do microbioma e do sistema imunológico na esquizofrenia. Biomarcadores de translocação bacteriana e permeabilidade intestinal, como CD14 solúvel e proteína de ligação a lipopolissacarídeos, correlacionam-se com os níveis de PCR em indivíduos com esquizofrenia e são influenciados pelo uso de antipsicóticos. Além disso, indivíduos com esquizofrenia exibem microbioma intestinal alterado β diversidade, com vias metabólicas ligadas a citocinas inflamatórias.
Da mesma forma, o microbioma oral mostrou aumento de Streptococcus e diminuição de Prevotella, com Streptococcus associado a TNF-α e IL-9 elevados, inflamação crônica e interrupção da BBB. Essas citocinas pró-inflamatórias foram associadas à inflamação crônica de baixo grau e a uma BHE interrompida. Mudanças na microbiota intestinal, como aumento de Eggerthella e diminuição de Bacteroides, correlacionam-se com marcadores inflamatórios como zonulina e PCR. Além disso, respostas plasmáticas aumentadas de IgM e IgA a cepas comensais (especificamente Hafniaalvei, Pseudomonasaeruginosa, Morganella morganii, Pseudomonas putida e Klebsiella pneumoniae) foram observadas em indivíduos com deficiências neurocognitivas, ligando o microbioma à imunidade inata e adaptativa. Essas descobertas sugerem interações complexas entre microbioma e imunidade na esquizofrenia, incluindo papéis potenciais na interação gene-ambiente.
ASDs
Os ASDs também são distúrbios multifacetados do neurodesenvolvimento caracterizados por déficits na comunicação e nas habilidades sociais e comportamentos estereotipados repetitivos. A alta prevalência de comorbidades gastrointestinais em crianças autistas estimulou o interesse no papel do microbioma intestinal na patogênese do TEA. Amostras fecais de CIA mostraram aumento de Bacteroidetes e alterações na colonização dos gêneros Bifidobacterium, Lactobacillus, Prevotella e Ruminococcus e foram associadas ao aumento da inflamação e ativação imunológica. De fato, a Bifidobacterium está normalmente associada à atividade anti-inflamatória protetora e, portanto, seus níveis reduzidos de TEA foram sugeridos como deletérios em vez de protetores. A inflamação crônica no TEA se sobrepõe aos transcriptomas da doença inflamatória intestinal, enquanto as células mononucleares do sangue periférico de crianças com TEA produzem citocinas elevadas associadas à mucosa (IL-5, IL-15 e IL-17) e zonulina, implicando a permeabilidade intestinal.
A ativação imunológica materna (MIA) devido a infecções, distúrbios autoimunes ou inflamação durante a gravidez aumenta o risco de TEA na prole. As principais citocinas inflamatórias, incluindo IL-6 e IL-17A, interrompem o desenvolvimento do cérebro fetal, levando a anormalidades no neurodesenvolvimento. Modelos de camundongos de MIA demonstraram que a inflamação materna altera a conectividade cerebral, o comportamento e o priming imunológico da prole, sendo a IL-17A um mediador crítico. Evidências emergentes destacam o papel do microbioma intestinal materno na modulação dos efeitos do MIA, sugerindo potenciais alvos de intervenção.
Outras evidências da ligação entre o microbioma intestinal e o sistema imunológico no TEA vêm de estudos usando probióticos e prebióticos em um modelo de rato com ácido valpróico (VPA). Um tratamento probiótico multicepa (VSL # 3) correlacionou-se com melhora da sociabilidade, interação social e comportamentos semelhantes à ansiedade, bem como resgate de aumentos induzidos por VPA em IL-6 e diminuição dos níveis de 5-HT no córtex pré-frontal.
Além disso, dietas prebióticas específicas (3% de galacto-oligossacarídeos [GOS]/fruto-oligossacarídeos [FOS]) demonstraram mitigar os efeitos do VPA, restaurando as comunidades microbianas, a permeabilidade intestinal e reduzindo a neuroinflamação associada ao cerebelo. Também aumentou as Tregs Foxp3+ em camundongos expostos ao VPA, indicando a modulação do equilíbrio imunológico.
Em conjunto, esses estudos destacam a complexa interação entre o microbioma intestinal e o sistema imunológico no TEA e sugerem que os sintomas podem ser mitigados por meio do direcionamento desse eixo.
Transtorno de déficit de atenção e hiperatividade
O transtorno de déficit de atenção e hiperatividade (TDAH) é uma condição do neurodesenvolvimento caracterizada por desatenção, hiperatividade e impulsividade, com crescente atenção ao papel do microbioma em seu desenvolvimento. Pesquisas indicam que fatores dietéticos, particularmente uma dieta de estilo ocidental e dietas de eliminação, podem influenciar os sintomas de TDAH, afetando a microbiota intestinal.
Níveis aumentados do gênero Bifidobacterium em indivíduos com TDAH podem estar ligados à regulação de precursores de dopamina derivados do intestino. Os efeitos de uma dieta de poucos alimentos nos sintomas de TDAH descobriram que 63% dos participantes apresentaram uma redução significativa nos sintomas.
Embora as alterações na ativação cerebral em regiões relacionadas ao controle inibitório não tenham se correlacionado com a melhora dos sintomas, o aumento da ativação na região precuneus foi associado à diminuição dos sintomas de TDAH, sugerindo um mecanismo neurocognitivo pelo qual a dieta de poucos alimentos pode exercer seus benefícios.Uma revisão sistemática recente dos efeitos benéficos de prebióticos, probióticos e simbióticos no TDAH descobriram que cepas específicas de bactérias, como L. rhamnosus e Bifidobacterium bifidum, podem influenciar positivamente os resultados neurocognitivos e comportamentais. Outra revisão sistemática identificou diferenças nas características do microbioma intestinal associadas ao TDAH, destacando um aumento da abundância de gêneros como Odoribacter e Eggerthella, ligados ao metabolismo da dopamina, e uma diminuição da abundância de Faecalibacterium, associada à inflamação. Embora tenham surgido algumas correlações entre as características da microbiota intestinal e a sintomatologia do TDAH, a revisão ressalta a necessidade de mais estudos para explorar essas relações, considerando fatores como variações geográficas, idade e hábitos alimentares, que podem influenciar a conexão intestino-cérebro no TDAH.
Doenças autoimunes
Esclerose múltipla
As ligações entre a comunicação imunológica da microbiota e doenças autoimunes, como a esclerose múltipla (EM), estão bem estabelecidas. A EM, uma doença autoimune crônica caracterizada pela destruição da mielina no SNC, está associada a alterações do microbioma correlacionadas com o aumento da expressão de vias inflamatórias em monócitos.
Probióticos contendo táxons esgotados em pacientes com EM (Lactobacillus, Bifidobacterium e Streptococcus) induziram respostas anti-inflamatórias e reduziram a ativação de monócitos, destacando a comunicação intestino-imune na patologia da EM. Na interface entre a imunidade inata e adaptativa estão as DCs, células apresentadoras de antígenos profissionais que desempenham um papel importante na ativação dos linfócitos T. As DCs são reguladas pelo microbioma intestinal, com SCFAs promovendo a hematopoiese DC por meio da expressão do ligante tirosina quinase 3 relacionada a Fms.
Realizados em modelos pré-clínicos de EM (encefalomielite autoimune experimental [EAE]), probióticos como o Lactibiane Iki melhoraram os resultados clínicos, reduzindo a desmielinização e induzindo um fenótipo tolerogênico de DC. Da mesma forma, Saccharomyces cerevisiae e seu derivado Selemax aumentaram CD103 DCs e reduziram a inflamação intestinal. Pesquisas recentes destacaram o papel das meninges na vigilância imunológica.
As células meníngeas IgA+, que dependem do microbioma intestinal, aumentam em resposta à inflamação intestinal e amortecem a inflamação associada à EAE. O mimetismo molecular também contribui para a EAE, com L. reuteri produzindo peptídeos que imitam a glicoproteína de oligodendrócitos de mielina (MOG), exacerbando a autoimunidade.
No geral, dado que a complexidade do microbioma leva a um aumento na diversidade de IgA, é tentador especular que direcionar ou modificar a IgA no intestino pode representar um caminho terapêutico para o tratamento de distúrbios cerebrais. A dieta influencia a função das células B, com implicações para o desenvolvimento neuronal, particularmente o subtipo B1a envolvido na mielinização. Como mencionado anteriormente, há evidências crescentes que implicam o microbioma intestinal no início e progressão da EM, com pesquisadores observando mudanças na composição de certos comensais em pacientes com EM. Isso inclui translocação de baixo nível de componentes da parede celular bacteriana, interrupção da BHE ou alterações na expressão de genes envolvidos na mielinização. O FMT de indivíduos com EM em camundongos livres de germes piorou os sintomas da EAE, reduzindo as Tregs IL-10+ e aumentando a produção de anticorpos anti-MOG, ressaltando o papel do microbioma na patologia da EM.
O pré-tratamento com antibióticos aumentou a população de células T e B reguladoras, levando a uma redução na gravidade da EAE ao alterar os perfis de citocinas, sugerindo que a modulação da microbiota pode afetar a autoimunidade da EM. No geral, esses estudos sugerem o potencial de utilizar o microbioma intestinal para reduzir as respostas autoimunes em distúrbios como a EM.
Doenças neurodegenerativas
Já se passaram mais de duas décadas desde que a pesquisa seminal postulou que a causa da DP pode começar no intestino. Esse distúrbio neurodegenerativo relacionado à idade, marcado por perda de neurônios dopaminérgicos, acúmulo de α-sinucleína e neuroinflamação, geralmente se apresenta com constipação anos antes do diagnóstico. α-sinucleína foi identificada em fibras nervosas intestinais e gânglios, e modelos de camundongos mostram que a microbiota intestinal influencia a agregação de α-sinucleína e a depuração de proteínas.
Além disso, o nervo vago pode mediar o transporte de α-sinucleína do intestino para o cérebro, apoiado por descobertas de que a vagotomia troncular diminui o risco de DP e interrompe a progressão da α-sinucleinopatia em camundongos.
No entanto, não há consenso sobre se existe um padrão microbiano distinto específico para DP, em parte devido a estudos longitudinais limitados e pequenos tamanhos de amostra.As ligações imunológicas com a DP estão bem documentadas, com genes que regulam a atividade imunológica e a sinalização de citocinas associadas ao risco de DP.
Pesquisas emergentes sugerem que a inflamação originada do intestino desempenha um papel patológico na DP, impulsionando o desenvolvimento de terapias imunológicas direcionadas à α-sinucleína e mediadores imunológicos. A análise post-mortem do tecido cerebral da DP mostra um aumento na ativação do complemento, na produção de citocinas e quimiocinas e na ativação do inflamassoma, tudo associado à ativação microglial, indicando envolvimento do sistema imunológico ao longo da progressão da doença.
Estudos de microbioma revelaram descobertas consistentes em todas as populações. A redução da abundância de Prevotella foi relatada em coortes da Alemanha, Finlândia, Rússia e Japão, sugerindo um padrão global independente da etnia ou dieta. O aumento da Akkermansia muciniphila correlacionou-se com a constipação em pacientes com DP, enquanto as bactérias produtoras de AGCC alteradas são características da DP, potencialmente ligando a desregulação do AGCC à neuroinflamação.
As associações entre Bacteroides e TNF-α, bem como Verrucomicrobia e interferon-gama (IFNγ), destacam ainda mais as interações microbiota-imunes na DP. Está ficando claro que o microbioma é necessário para a progressão da DP, e trabalhos futuros devem identificar a composição do microbioma em pontos de tempo distintos durante o desenvolvimento da doença, incluindo a fase prodrômica.
A DA é o distúrbio neurodegenerativo mais prevalente, levando à demência, e é caracterizada pela formação de placas Aβ, proteína tau hiperfosforilada e emaranhados neurofibrilares, perda neuronal e neuroinflamação. A doença progride do córtex transentorrinal para o hipocampo e áreas corticais. Embora o acúmulo de Aβ seja central para a DA, a neuroinflamação acelera o declínio cognitivo, com a ativação do receptor do tipo Toll por Aβ desencadeando complexos de inflamassoma e inflamação causada pela microglia.
A tau mal dobrada interrompe a renovação de proteínas nas sinapses, contribuindo ainda mais para a disfunção neuronal. No entanto, se o acúmulo de Aβ é uma resposta imune desregulada ou um fator direto da DA permanece uma questão em aberto, necessitando de mais pesquisas.Evidências emergentes ligam micróbios patogênicos à patogênese da DA. Níveis elevados de Bacteroides em camundongos com DA se correlacionam com a redução da atividade fagocítica microglial, promovendo o acúmulo de Aβ.
Indivíduos com DA geralmente exibem desequilíbrios da microbiota intestinal com diversidade microbiana reduzida, diminuição de bactérias benéficas como Eubacterium rectale, Bifidobacterium e Dialister, e aumento de bactérias patogênicas, incluindo Escherichia/Shigella, Bacteroides e Ruminococcus. Foi relatada uma correlação observada entre níveis elevados de Escherichia/Shigella e aumento de citocinas pró-inflamatórias (IL-1β e a quimiocina CXCL2) no soro de indivíduos com DA, sugerindo uma ligação entre alterações da microbiota intestinal e inflamação periférica na DA.
As hipóteses propõem que o Aβ funciona como um peptídeo antimicrobiano, prendendo patógenos em agregados fibrilares. O envolvimento viral, particularmente o vírus herpes simplex 1 (HSV-1), está implicado na DA, pois o HSV-1 co-localizado com placas Aβ e emaranhados de tau no cérebro. Os anticorpos IgM anti-HSV-1 aumentaram o risco de DA, sugerindo que a reativação, em vez da persistência, pode conduzir à patologia.
Além disso, a inoculação de homogeneizados de DA de humanos em primatas e camundongos induziu a transmissibilidade da patologia semelhante à DA. As alterações da microbiota intestinal estão cada vez mais ligadas à DA. As alterações do microbioma induzidas por antibióticos modulam a neuroinflamação e a deposição de Aβ. Camundongos com proteína precursora de amilóide livre de germes / presenilina 1 mostraram patologia Aβ reduzida, enquanto FMT de doadores saudáveis reduziu anormalidades Aβ e tau em modelos de camundongos com DA.
Do ponto de vista terapêutico, a administração de L. plantarum preveniu o declínio cognitivo reduzindo a formação de placas Aβ e a hiperfosforilação de tau em um modelo de camundongo com DA. Por outro lado, evidências causais estão surgindo de estudos em animais mostrando que a microbiota de pacientes com DA pode induzir déficits cognitivos.
Os ensaios clínicos mostraram resultados mistos, com alguns probióticos melhorando a cognição na DA leve, mas efeitos limitados em casos avançados. Embora as terapias direcionadas ao microbioma para a DA sejam promissoras, mais pesquisas são necessárias para elucidar os mecanismos, desenvolver biomarcadores para detecção precoce e refinar as intervenções. Os tratamentos baseados em microbiota têm potencial como terapias adjuvantes para retardar ou interromper a progressão da DA, oferecendo uma abordagem transformadora para o gerenciamento dessa doença complexa.
Terapias propostas direcionadas à microbiota intestinal
Evidências emergentes que ligam a microbiota intestinal a distúrbios psiquiátricos e neurológicos por meio do eixo microbioma-intestino-cérebro imune levaram ao desenvolvimento de terapias direcionadas a esse eixo.
Essas terapias se concentram na modulação da microbiota intestinal para influenciar as respostas imunes e a função cerebral, com probióticos, prebióticos, simbióticos, pós-bióticos e FMT, combinados com treinamento sobre escolhas de estilo de vida e aconselhamento dietético, sendo as principais estratégias atualmente em investigação
Definições dos principais compostos que afetam a microbiota intestinal
| Alimentos | Definição |
|---|---|
| Alimentos fermentados | “alimentos feitos através do crescimento microbiano desejado e conversões enzimáticas de componentes alimentares |
| Prebiótico | “um substrato que é utilizado seletivamente por microrganismos hospedeiros que conferem um benefício à saúde |
| Probiótico | “microrganismos vivos, que quando administrados em quantidades adequadas, conferem um benefício à saúde do hospedeiro |
| Pós-biótico | “preparação de microrganismos inanimados e/ou seus componentes que conferem benefícios à saúde do hospedeiro” |
| Simbiótico | “uma mistura composta por microrganismos vivos e substrato(s) utilizado(s) seletivamente por microrganismos hospedeiros que conferem um benefício à saúde do hospedeir |
| Psicobiótico | “bactérias benéficas (probióticos) ou suporte para tais bactérias (prebióticos) que influenciam as relações bactéria-cérebro |
Em crianças com TEA/TDAH, desequilíbrios no eixo intestino-cérebro podem agravar sintomas como irritabilidade, dificuldade de concentração e problemas de sono. Por isso, intervenções que promovam a saúde intestinal, como mudanças na dieta, podem ter efeitos positivos no comportamento e no bem-estar geral.
Conheça Nossos Kits de Alimentação Funcional
Aqui na Alimentação Legal CY, desenvolvemos kits e combos personalizados para atender às mais diversas necessidades de saúde e bem-estar. Além de opções específicas para quem vive com TEA e TDAH, oferecemos:
- Kits para Diabetes, com refeições equilibradas e sem açúcar;
- Kits Detox e Anti-inflamatórios, ideais para desintoxicar e reduzir inflamações no organismo;
- Kits Funcionais Low Carb Triplo Zero, perfeitos para quem busca saúde e controle do peso;
- Kits de Bem-Estar Diário, com lanches práticos e nutritivos para o dia a dia.
Nossas opções são livres de glúten, caseína, açúcar e aditivos artificiais, garantindo sabor, saúde e praticidade em cada refeição.
Venha conhecer nossos produtos e descubra como uma alimentação saudável pode transformar sua vida! Clique aqui e solicite já o seu kit! 🥗✨
Referências
Cryan, J.F. ∙ O’Riordan, K.J. ∙ Cowan, C.S.M. … O eixo microbiota-intestino-cérebroFisiol. Rev. 2019; 99:1877-2013
Turnbaugh, P.J. ∙ Ley, R.E. ∙ Hamady, M. .O Projeto Microbioma HumanoNatureza. 2007; Rolamento 449:804-810
McCallum, G. ∙ Tropini, C. A microbiota intestinal e sua biogeografiaNat. Rev. Microbiol. 2024; 22:105-118
Macpherson, A.J. ∙ Pachnis, V. ∙ Prinz, M. Limites e integração entre microbiota, sistema nervoso e imunidadeImunidade. 2023; 56:1712-1726
Ratsika, A. ∙ Cruz Pereira, J.S. ∙ Lynch, C.M.K. … Interações microbiota-imuno-cérebro: uma perspectiva de vida útilCurr. Opinar. Neurobiol. 2023; 78, 102652
Cruz-Pereira, J.S. ∙ Rea, K. ∙ Nolan, Y.M. A Trindade Profana da Depressão: Estresse Desregulado, Imunidade e o MicrobiomaRev. Psychol. 2020; Números 71:49-78
Fülling, C. ∙ Dinan, T.G. ∙ Cryan, J.F. Micróbio intestinal para sinalização cerebral: o que acontece no vagoNeurônio. 2019; 101:998-1002
Sharkey, K.A. ∙ Mawe, G.M. O sistema nervoso entéricoFisiol. Rev. 2023; 103:1487-1564
De Schepper, H.U. ∙ De Man, J.G. ∙ Van Nassauw, L. … A colite distal aguda prejudica o esvaziamento gástrico em ratos por meio de uma via reflexa neuronal extrínseca envolvendo o nervo pélvico Barriga. 2007; Isaías 56:195-202
Pavlov, V.A. ∙ Tracey, K.J.O nervo vago e o reflexo inflamatório – ligando imunidade e metabolismoNat. Rev. Endocrinol. 2012; 8:743-754
Siopi, E. ∙ Galerne, M. ∙ Rivagorda, M. Alterações na microbiota intestinal requerem integridade do nervo vago para promover comportamentos depressivos em camundongosMol. Psiquiatria. 2023; 28:3002-3012
Vermeulen, W. ∙ De Man, J.G. ∙ Pelckmans, P.A. Neuroanatomia dos distúrbios da dor gastrointestinal inferiorMundo J. Gastroenterol. 2014; 20:1005-1020
De Vadder, F. ∙ Grasset, E. ∙ Mannerås Holm, L. .A microbiota intestinal regula a maturação do sistema nervoso entérico adulto por meio de redes de serotonina entéricaProc. Natl. Acad. Sci. EUA. 2018; 115:6458-6463
Obata, Y. ∙ Pachnis, V.O efeito da microbiota e do sistema imunológico no desenvolvimento e organização do sistema nervoso entéricoGastroenterologia. 2016; 151:836-844
Bellono, N.W. ∙ Bayrer, J.R. ∙ Leitch, D.B. .As células enterocromafins são quimiossensores intestinais que se acoplam a vias neurais sensoriaisCélula. 2017; 170:185-198.e16
Furness, J.B. O sistema nervoso entérico e a neurogastroenterologiaNat. Rev. Gastroenterol. Hepatol. 2012; 9:286-294
Lyte, J.M. ∙ Gheorghe, C.E. ∙ Goodson, M.S. … As respostas serotoninérgicas do eixo intestino-cérebro à exposição aguda ao estresse são dependentes do microbiomaNeuro Gastroenterol. Motil. 2020; 32, e13881
Gheorghe, C.E. ∙ Martin, J.A. ∙ Manriquez, F.V. .Concentre-se no essencial: metabolismo do triptofano e o eixo microbioma-intestino-cérebroCurr. Opinar. Farmacol. 2019; Números 48:137-145
Lavelle, A. ∙ Sokol, H. Metabólitos derivados da microbiota intestinal como atores-chave na doença inflamatória intestinal Nat. Rev. Gastroenterol. Hepatol. 2020; 17:223-237
De Palma, G. ∙ Shimbori, C. ∙ Reed, D.E. .A produção de histamina pela microbiota intestinal induz hiperalgesia visceral através da sinalização do receptor de histamina 4 em camundongosSci. Transl. Med. 2022; 14, eabj1895
Simpson, J.B. ∙ Walker, M.E. ∙ Sekela, J.J. .As beta-glucuronidases microbianas intestinais influenciam a homeostase endobiótica e são moduladas por diversas terapêuticas Micróbio Hospedeiro Celular. 2024; 32:925-944.e10
Kaelberer, M.M. ∙ Rupprecht, L.E. ∙ Liu, W.W. … Células de neurópodes: a biologia emergente da transdução sensorial intestino-cérebroRev. Neurosci. 2020; 43:337-353
Erny, D. ∙ Dokalis, N. ∙ Mezo, C. .Microbiota-derived acetate enables the metabolic fitness of the brain innate immune system during health and diseaseCell Metab. 2021; 33:2260-2276.e2267
Mossad, O. ∙ Batut, B. ∙ Yilmaz, B. .Gut microbiota drives age-related oxidative stress and mitochondrial damage in microglia via the metabolite N(6)-carboxymethyllysineNat. Neurosci. 2022; 25:295-305
Pinho-Ribeiro, F.A. ∙ Deng, L. ∙ Neel, D.V. .Bacteria hijack a meningeal neuroimmune axis to facilitate brain invasion Nature. 2023; 615:472-481
de Theije, C.G.M. ∙ Wopereis, H. ∙ Ramadan, M. .Altered gut microbiota and activity in a murine model of autism spectrum disorders Brain Behav. Immun. 2014; 37:197-206
Xie, A. ∙ Ensink, E. ∙ Li, P. Butirato bacteriano na doença de Parkinson está ligado a alterações epigenéticas e sintomas depressivosMov. Desord. 2022; 37:1644-1653
Kaneko, R. ∙ Matsui, A. ∙ Watanabe, M. O aumento de neutrófilos na doença inflamatória intestinal acelera o acúmulo de placas amilóides no modelo de camundongo da doença de AlzheimerInflamm. Regen. 2023; 43:20